Nowotwór złośliwy to choroba, w której organizm traci kontrolę nad pracą komórek. Zaczynają się one rozmnażać w szybkim tempie i nie funkcjonują już prawidłowo. Rak jest zwykle przypisywany do konkretnego organu. Najczęstszy guz mózgu w praktyce neuroonkologicznej dorosłych to wysoce agresywny i inwazyjny glejak wielopostaciowy. Naukowcy opracowują metody leczenia, a jedną z obiecujących strategi są kannabinoidy.
Skuteczność marihuany w leczeniu glejaka – badania i wyniki
Badania o właściwościach przeciwnowotworowych kannabinoidów sięgają 1974 roku. Zauważono wtedy, że kannabinoidy takie jak delta-9 THC, delta-8 THC oraz CBN znacznie zmniejszały lub eliminowały raka płuc, piersi i białaczkę u myszy. Co ciekawe, badanie miało wykazać, że marihuana uszkadza układ odpornościowy. Kiedy się jednak okazało, że ma, potencjał leczniczy temat ucichł. W tamtych czasach USA rozpoczęło wojnę z narkotykami, w tym z marihuaną i rządowi nie były na rękę jej lecznicze właściwości.
Obecnie coraz więcej danych wykazuje zdolność kannabinoidów do zmniejszania się, a nawet zabijania rozprzestrzeniających się komórek rakowych.
Glejak mózgu
Glejak wielopostaciowy (GBM, łac. glioblastoma multiforme) to najczęściej występujący guz wewnątrzczaszkowy, jednocześnie najbardziej agresywny. Ze względu na złe rokowanie i silną oporność na leczenie, ten nowotwór ośrodkowego układu nerwowego pilnie wymaga nowego, innowacyjnego leczenia. Glejak mózgu jest nowotworem składającym się z szeregu komórek zrębu i różnych komórek złośliwych przyczyniających się do inicjacji, progresji i odpowiedzi na leczenie. Kannabinoidy wykazują działanie przeciwnowotworowe wobec linii komórkowych glejaka i w modelach zwierzęcych.
Badanie „Celowanie w układ endokannabinoidowy obecny w mikrośrodowisku glejaka. Mikrośrodowisko guza jako potencjalna strategia przeciwnowotworowa” zostało opublikowane w International Journal of Molecular Science.
Badacze skupili się na tym, aby ulepszyć istniejące leczenie glejaka mózgu. W związku z tym kannabinoidy w postaci sfunkcjonalizowanych ligand na nanonośnikach zostały zbadane jako potencjalne środki przeciwnowotworowe. Istniejące bariery w leczeniu glejaka wielopostaciowego za pomocą kannabinoidów. Należą do nich przekraczanie bariery krew-mózg oraz psychoaktywne skutki uboczne. Naukowcy sprawdzili, czy można złagodzić je za pomocą nanonośnikowych systemów dostarczania leków.
Klasyfikacja
Najnowsza wersja klasyfikacji guzów ośrodkowego układu nerwowego (OUN) została opublikowana przez Światową Organizację Zdrowia (WHO). Jest ważnym narzędziem do diagnozowania i leczenia guzów mózgu, w tym glejaka wielopostaciowego. Glejaki to wysoce inwazyjne i rozproszone guzy charakteryzujące się szybką proliferacją, angiogenezą (komórki rakowe tworzą nowe naczynia krwionośne, przez które odżywiają się kosztem zdrowych komórek) i opornością na leczenie. Pomimo znacznego postępu w zrozumieniu ich biologii i rozwoju nowych podejść terapeutycznych, rokowania dla pacjentów pozostają złe.
Jednym z głównych wyzwań w leczeniu jest bardzo złożony i dynamiczny charakter mikrośrodowiska guza. Odgrywa ono kluczową rolę we wzroście guza, inwazji i oporności na leczenie. Mikrośrodowisko obejmuje różne typy komórek, w tym komórki nowotworowe, astrocyty, mikroglej, komórki śródbłonka i komórki odpornościowe, a także składniki macierzy zewnątrzkomórkowej, czynniki wzrostu i cytokiny.
Rola układu endokannannabinoidowego w leczeniu glejaka
Układ endokannabinoidowy (ECS) jest szeroko rozpowszechnioną siecią neuromodulacyjną. Odgrywa rolę w rozwijającym się i dojrzałym układzie nerwowym poprzez modulowanie funkcji sieci i aktywności neuronów.
Na układ endokannabinoidowy składają się:
- Receptory kannabinoidowe sprzężone z białkiem G, w tym kanoniczne podtypy receptora kannabinoidowego typu 1 (CB1) i receptora kannabinoidowego typu 2 (CB2)
- endogenne kannabinoidy znane jako endokannabinoidy – czyli wytwarzane naturalnie przez nasz organizm (np. anandamid i 2-arachidonoiloglicerol)
- białka, które syntetyzują i degradują endokannabinoidy, hydrolaza amidu kwasu tłuszczowego (FAAH) i lipaza monoacyloglicerolu (MAGL)
Oprócz enzymów zaangażowanych w biosyntezę i degradację endokannabinoidów inna rozszerzona sieć sygnalizacyjna ECS obejmuje receptory GPR55 i PPARα, inotropowe receptory kannabinoidowe (kanały TRP), transportery białek (rodzina FABP) i inne pochodne kwasów tłuszczowych.
Receptory kannabinoidowe
Jak leczenie marihuaną wpływa na glejaka mózgu? Receptory kannabinoidowe są obecne w większości tkanek. Receptor CB1 występuje głównie i głównie w ośrodkowym układzie nerwowym, umiarkowanie w tkance tłuszczowej, limfoidalnej oraz w mniejszych ilościach w innych tkankach. Układ endokannabinoidowy stał się potencjalnym celem w leczeniu glejaka. To złożony system sygnalizacyjny, który odgrywa kluczową rolę w utrzymaniu homeostazy (równowagi) w organizmie. Obejmuje różne procesy fizjologiczne, w tym modulację bólu, apetyt, nastrój i funkcje odpornościowe. Najnowsze dowody sugerują, że u osób chorych na glejaka układ endokannabinoidowy jest rozregulowany, a jego manipulacja może stanowić obiecującą strategię terapeutyczną. W szczególności wyżej wspomniane receptory CB1 i CB2 ulegają ekspresji w komórkach glejaka i mikrośrodowisku guza, w tym w komórkach odpornościowych i komórkach śródbłonka. W badaniach przedklinicznych wykazano, że aktywacja tych receptorów wywołuje efekty przeciwnowotworowe, w tym hamowanie proliferacji komórek nowotworowych, migracji, inwazji i angiogenezy.
Apoptoza komórek nowotworowych
Co więcej, w komórkach glejaka odnotowano apoptozę (samozniszczenie komórki) indukowaną kannabinoidami. Pomimo obiecujących danych przedklinicznych, kliniczne przełożenie większości kannabinoidów na leczenie glejaka stoi przed poważnymi wyzwaniami, w tym słabą rozpuszczalnością w wodzie, ograniczoną biodostępnością i słabą farmakokinetyką. To problem, który od lat pojawia się w badaniach dotyczących leczenia raka za pomocą kannabinoidów. Główne bariery to dawki w poszczególnych przypadkach oraz droga podania. Jak rozprowadzać kannabinoidy w organiźmie poprzez układ krwionośny? Na te pytania starają się odpowiedzieć naukowcy.
„Ograniczenia doprowadziły do zbadania nowych systemów dostarczania leków, w tym nanonośników, które wykazały obiecujące wyniki w badaniach przedklinicznych. Nanonośniki to nanoskalowe systemy dostarczania leków, które mogą kapsułkować leki hydrofobowe, takie jak kannabinoidy, i chronić je przed degradacją, zwiększać ich rozpuszczalność oraz biodostępność”. – czytamy w badaniu
Złożony i dynamiczny charakter mikrośrodowiska glejaka stanowi poważne wyzwanie dla rozwoju skutecznych terapii. W związku z tym badacze dokonali przeglądu ostatnich postępów w zakresie rozregulowania układu endokannabinoidowego u chorych na glejaka i jego potencjału jako celu terapeutycznego, wraz z rozwojem nowych systemów dostarczania leków, w tym nanotechnologii. Takie działania mają na celu zaoferowanie obiecującego podejścia do przyszłego leczenia tej śmiertelnej choroby.
Rodzaje glejaków i ich klasyfikacja
Glejak stanowi 45,2% złośliwych guzów mózgu i ośrodkowego układu nerwowego. Jest to ogólny termin opisujący pierwotne guzy mózgu, jednak te guzy układu nerwowego są klasyfikowane zgodnie z ich przypuszczalną komórką pochodzenia. Centralny układ nerwowy obejmuje mózg i rdzeń kręgowy, a obwodowy układ nerwowy wywodzi się z komórek neurogleju zawierających różne typy komórek glejowych, w tym astrocyty, oligodendrocyty, komórki wyściółki i mikrogleju.
Rada Redakcyjna Klasyfikacji Nowotworów WHO opublikowała skalę złośliwości glejaków sklasyfikowanych od I do IV i zdefiniowanych przez rosnącą agresywność i cechy histologiczne:
- Guzy I stopnia są łagodne i charakteryzują się stosunkowo wolnym tempem proliferacji.
- Guzy II stopnia również charakteryzują się powolnym tempem wzrostu, znacznym stopniem zróżnicowania komórkowego i dyfuzyjnym wzrostem (takim, który zajmuje cały obszar) do miąższu mózgu, co czyni je bardziej podatnymi na progresję złośliwą.
- Guzy III stopnia charakteryzują się dużą ilością atypii (nieprawidłowe cechy złościwości w budowie komórek) w połączeniu z większą gęstością komórkową.
- Guzy stopnia IV posiadają cechy charakterystyczne dla guzów stopnia III, oprócz proliferacji mikronaczyniowej i martwicy rzekomej. Guzy IV stopnia, takie jak glejak wielopostaciowy, są najbardziej złośliwe i są one również najczęstszym pierwotnym guzem mózgu.
Klasyfikacje glejaka stworzone przez WHO miały wpływ na powiązanie zmian genomowych lub molekularnych z fenotypami klinicznymi glejaków. Wcześniej pierwotne guzy ośrodkowego układy nerwowego były klasyfikowane zgodnie z parametrami histologicznymi i przypisywano im stopień od I do IV. Klasyfikacja została zmieniona w celu połączenia charakterystycznych molekularnych zmian genetycznych z klasyczną histologią, co skutkuje zintegrowaną diagnozą, w której po histopatologicznej nazwie guza następują cechy genetyczne.
Według powyższej klasyfikacji CNS5 glejaki dzieli się w następujący sposób:
- (1) Glejaki rozlane typu dorosłego
- (2) Glejaki rozlane o niskim stopniu złośliwości typu pediatrycznego
- (3) Glejaki rozlane o wysokim stopniu złośliwości typu pediatrycznego
- (4) Glejaki astrocytarne (gwiaździaki)
- (5) Guzy glioneuronalne i neuronalne
- (6) Wyściółczaki
Pomimo wielu prób leczenia glejaka, pozostaje on chorobą nieuleczalną o złym rokowaniu i medianie czasu przeżycia wynoszącej około 15 miesięcy. Krótki wskaźnik przeżywalności przypisuje się ekspansji pierwotnego guza mózgu poprzez rozproszoną inwazję, co skutkuje zaburzeniem zdrowej budowy mózgu.
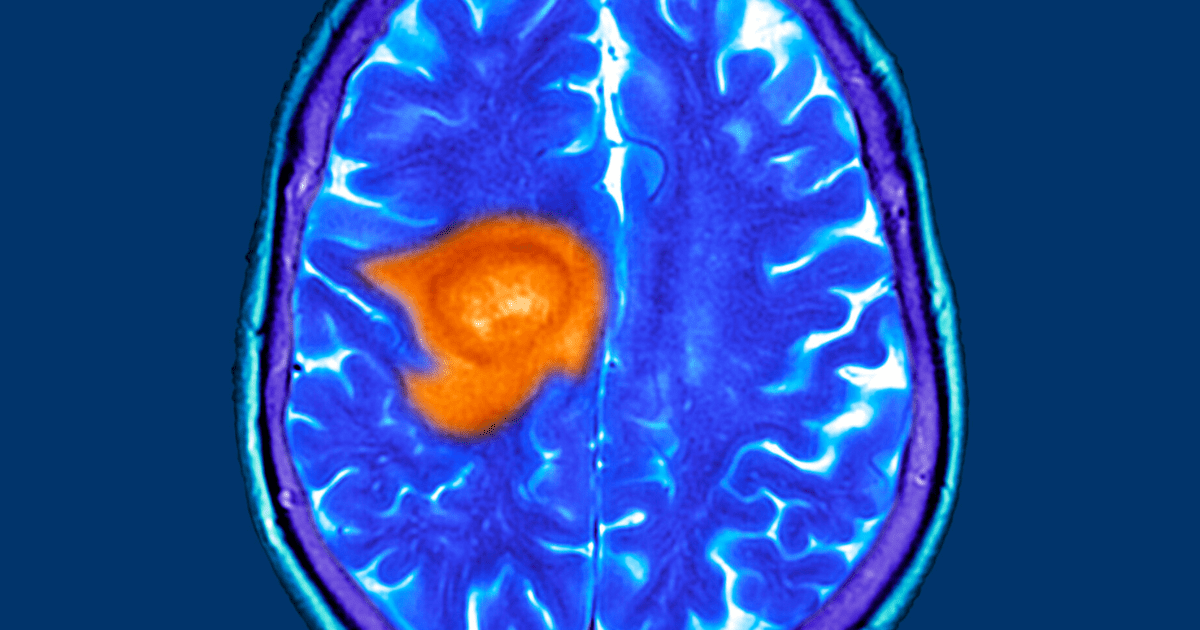
Etiologia
Etiologia większości glejaków pozostaje nieznana. Niewielka populacja jest dziedziczona genetycznie. Potencjalne przyczyny to promieniowanie niejonizujące pochodzące z telefonów komórkowych i czynniki narażenia zawodowego, jednak wyniki pozostają negatywne lub niejednoznaczne. W przeszłości nowotwory występowały znacznie rzadziej, jednak znacznie zwiększyła się ilość czynników rakotwórczych.
Epidemiologia
Glejak występuje głównie u osób starszych, ze szczytem zachorowań u pacjentów w wieku 55-85 lat. Stosunek zachorowalności mężczyzn do kobiet na GBM wynosi 1,4, co wskazuje na wyższą częstotliwość występowania wśród mężczyzn w porównaniu do kobiet. W USA stosunek M:K wynosi 1,60:1 a w Szwajcarii 1,28:1. Spójne wyniki wskazują, że zachorowalność na GBM jest najwyższa w populacji rasy kaukaskiej w porównaniu do populacji afrykańskiej lub azjatyckiej. Co roku diagnozuje się od 3 do 5 na 100 000 mieszkańców.
Lokalizacja
GBM często koncentruje się w podkorowej istocie białej i głębszej istocie szarej półkul mózgowych, co wpływa na wszystkie płaty mózgowe. Gdy dochodzi do naciekania guza, rozprzestrzenia się on na sąsiednią korę mózgową i półkulę przeciwną poprzez ciało modzelowate. Stwierdzono również, że guz wpływa na pień mózgu, móżdżek i rdzeń kręgowy.
Histopatologia
Kluczowymi cechami wymaganymi do histologicznego rozpoznania GBM są atypia cytologiczna i wysoka aktywność mitotyczna w połączeniu z martwicą.
Klasyfikacja molekularna
Wysoka proliferacja komórkowa i angiogeneza skutkujące szybkim wzrostem guza i martwicą. Wysoka migracja i właściwości inwazyjne. Komórki macierzyste glejaka częściowo odpowiadają za wysoką oporność na leczenie i wskaźniki nawrotów.
Objawy glejaka mózgu
Ból, trudności w komunikowaniu się, zaburzenia poznawcze, drgawki, osłabienie, zmęczenie i afazja (zaburzenie mowy).
Cechy charakterystyczne nowotworów
W ciągu ostatnich 50 lat postępu w badaniach nad nowotworami pojawił się i nadal pojawia bogaty i wieloaspektowy zbiór wiedzy. Dotychczas ujawnił, że rak jest dynamiczną chorobą obejmującą zmiany w ludzkim genomie. Wskazuje, że nowotwór jest wieloetapowym procesem odzwierciedlającym zmiany genetyczne, które kierują transformacją normalnych ludzkich komórek w wysoce złośliwe pochodne. W 2000 roku badacze wskazali, że obszerny katalog genotypów komórek nowotworowych jest wyrazem sześciu istotnych zmian w fizjologii komórek, które wspólnie kontrolują złośliwy wzrost, co nazwali cechami charakterystycznymi raka. Sześć cech charakterystycznych raka sugerowało unikanie apoptozy, niewrażliwość na sygnały zapobiegające wzrostowi, samowystarczalność w zakresie sygnałów wzrostu, utrzymującą się angiogenezę, inwazję tkanek i przerzuty oraz nieograniczony potencjał replikacyjny.
Nabyte zdolności raka to zmiany fizjologiczne zachodzące podczas rozwoju guza, które naruszają mechanizmy obrony przeciwnowotworowej obecne w tkankach i komórkach i można je znaleźć we wszystkich typach ludzkich nowotworów. W miarę postępu badań naukowcy rozszerzyli cechy charakterystyczne raka z sześciu, do ośmiu. Dlatego też, oprócz istniejących zdolności charakterystycznych, plastyczność fenotypowa i zaburzone różnicowanie pojawiły się jako odrębne zdolności charakterystyczne. Komórki starzejące się okazały się również funkcjonalnie ważnymi typami komórek w mikrośrodowisku nowotworu.
Działanie kannabinoidów na komórki nowotworowe w przypadku glejaka
Układ endokannabinoidowy obejmuje endokannabinoidy i enzymy, które je syntetyzują i degradują. Jego zakres to także transportery i receptory sprzężone z białkiem G zaangażowane w ich sygnalizację. Został znaleziony w komórkach glejaka. ECS to system homeostatyczny, który wykorzystuje cząsteczki sygnalizacyjne pochodzące z lipidów do regulacji szerokiego zakresu funkcji fizjologicznych. Badania wykazały wysoki poziom receptorów kannabinoidowych, CB1 i CB2, a także receptora TRPV1 wyrażonego na komórkach glejaka, które są regulowane przez mechanizmy genetyczne i epigenetyczne.
„Zgodnie z analizą immunohistochemiczną, receptory CB1 i CB2 wykryto odpowiednio w około 38% i 54% komórek śródbłonka glejaka. Stwierdzono, że poziomy ekspresji receptora CB2 w tkankach glejaka były wyższe niż CB1. Odkrycia te sugerują, że selektywni agoniści CB2 mogą potencjalnie służyć jako kluczowe cele w leczeniu glejaka”. – informują autorzy
Aktywacja receptora kannabinoidowego może prowadzić do modulacji dalszych szlaków sygnałowych w komórkach glejaka. W konsekwencji, aktywacja tych szlaków może wpływać na proliferację, przeżycie i migrację komórek, w zależności od konkretnego kontekstu i równowagi sygnałów wejściowych.

Kannabidiol i inne kannabinoidy a nowotwór mózgu
W coraz większej liczbie modeli przedklinicznych i badań klinicznych badano działanie kannabinoidów na różne nowotwory. Doniesienia wykazały rozregulowanie receptorów kannabinoidowych i endogennych ligandów obecnych w mikrośrodowisku nowotworowym guzów nowotworowych. Rola układu endokannabinoidowego sugeruje zarówno działanie przeciwnowotworowe w zależności od rodzaju i miejsca raka.
W jednym z badań oceniono skuteczność kannabidiolu (CBD) w neuroblastomie, nowotworze układu nerwowego u dzieci. Dwa kannabinoidy CBD i THC, zostały eksperymentalnie przetestowane w celu określenia wpływu związków na inwazyjność, programowaną śmierć komórek, żywotność i rozkład cyklu komórkowego w ludzkich komórkach neuroblastomy in vitro. Kannabinoidy oceniono również pod kątem ich zdolności do zmniejszania wzrostu ksenograftów nowotworowych in vivo u myszy.
„Wyniki wykazały, że zarówno THC, jak i CBD miały działanie przeciwnowotworowe in vitro. CBD było jednak bardziej aktywne niż THC w zmniejszaniu inwazyjności, apoptozy, żywotności i rozkładu cyklu komórkowego komórek neuroblastomy. In vivo CBD wykazywało również większą skuteczność niż THC w zmniejszaniu wzrostu ksenograftów nowotworowych u myszy”. – czytamy w przeglądzie
Poziom endokannabinoidów i ekspresja ich receptorów obecnych w mikrośrodowisku glejaka są rozregulowane w stanie chorobowym. Uważa się, że to przyczynia się do wzrostu i progresji guzów.
Mechanizmy związane z wpływem kannabinoidów na wzrost glejaka obejmują mechanizmy indukujące śmierć komórek, antyangiogenne i antyproliferacyjne. Śmierć komórek indukowana kannabinoidami jest wywoływana przez aktywację wewnętrznego szlaku apoptozy poprzez interakcję kannabinoid-receptor, co skutkuje zwiększeniem wewnątrzkomórkowego ceramidu, hamując w ten sposób szlaki.
Trudności w terapii medyczną marihuaną
Właściwości fizykochemiczne większości kannabinoidów, w tym wysoka lipofilowość, słaba rozpuszczalność w wodzie i niestabilność chemiczna, stanowią poważne wyzwanie dla opracowania skutecznych terapii guzów mózgu. Postępy w nauce i technologii farmaceutycznej pomagają jednak przezwyciężyć te wyzwania i wykorzystać potencjał kannabinoidów w leczeniu.
„Lipofilowa natura kannabinoidów może być korzystna dla dostarczania kannabinoidów do mózgu, ale ma tendencję do tworzenia agregatów koloidalnych (mieszanin niejednorodnych, co finalnie okazuje się trudne do osiągnięcia odpowiedniej rozpuszczalności i stabilności w roztworach wodnych. Posiadają one jednak atrakcyjny skład jako nanocząsteczki do ukierunkowanego dostarczania leków. Połączenie białek ligandowych i polimerów może być wykorzystane do stabilizacji agregatów koloidalnych, zmniejszenia rozmiaru koloidu i poprawy trwałości w krążeniu krwi”. – informują badacze
Metody leczenia glajaka mózgu
Terapią pierwszego rzutu w przypadku pierwotnego glejaka wielopostaciowego jest interwencja chirurgiczna poprzedzona radioterapią i chemioterapią. Ten protokół leczenia sprawia, że choroba pozostaje nieuleczalna, a czas przeżycia wydłuża się jedynie do 15 miesięcy od diagnozy. Standardowe leczenie pacjentów w dobrym stanie sprawności jest zgodne z protokołem Stuppa dla glejaka wielopostaciowego, w którym po maksymalnie bezpiecznej resekcji chirurgicznej guza następuje pooperacyjne napromienianie jonizujące (radioterapia) samodzielnie lub przy jednoczesnym stosowaniu chemioterapii temozolomidem (TMZ). Temozolomid należy do klasy związków imidazotetrazyny i działa jako prolek, który jest przekształcany do aktywnego metabolitu MTIC poprzez spontaniczną hydrolizę w organizmie. Jest przepisywany w leczeniu pierwotnego złośliwego glejaka wielopostaciowego w połączeniu z radioterapią, a także w leczeniu czerniaka złośliwego.
Oprócz standardowych metod leczenia istnieje również kilka nowych i pojawiających się metod leczenia glejaka wielopostaciowego, które są obecnie badane. Obejmują one immunoterapię, która polega na wykorzystaniu własnego układu odpornościowego organizmu do walki z nowotworem, oraz terapię celowaną, która wykorzystuje leki ukierunkowane na komórki nowotworowe, oszczędzając jednocześnie zdrowe komórki. Obecność bariery krew-mózg (BBB) i brak naczyń limfatycznych w mózgu były powodem, dla którego układ odpornościowy był wcześniej zaniedbywany w leczeniu guzów mózgu.
„Chociaż operacja jest często pierwszą opcją leczenia, komórki glejaka wykazują rozproszony wzór inwazji, powodując, że komórki nowotworowe przenikają do zdrowej tkanki mózgowej poza marginesem guza, dlatego często trudno jest usunąć cały guz”. – czytamy w przeglądzie
Marihuana a tradycyjne metody leczenia glejaka
Pierwsze pilotażowe badanie kliniczne fazy I na ludziach, testujące przeciwnowotworowe działanie kannabinoidów u pacjentów z nawracającym glejakiem wielopostaciowym, zostało przeprowadzone przez w 2006 roku. W badaniu dziewięciu pacjentom podano do guza THC. Pacjenci przeszli wcześniej nieudaną standardową terapię, w tym operację i radioterapię, wykazując jednocześnie wyraźne dowody progresji guza.
„Oceniono bezpieczeństwo i dawkowanie wewnątrzczaszkowego podawania THC, a także wpływ THC na długość przeżycia pacjentów i inne parametry komórek nowotworowych. Dostarczanie kannabinoidów zostało bezpiecznie osiągnięte bez widocznych efektów psychoaktywnych, a mediana przeżycia pacjentów wynosiła 24 tygodnie (95% przedział ufności: 15-33 tygodnie) od rozpoczęcia podawania kannabinoidów. Badanie potwierdziło, że THC nie ułatwia wzrostu guza ani nie zmniejsza przeżywalności pacjentów z GBM z ekspresją receptorów kannabinoidowych”. – czytamy w badaniu
Badanie z 2011 wykazało, że łączne podawanie THC i TMZ wywierało silne działanie przeciwnowotworowe w ksenograftach glejaka. Efekt ten występował również w guzach opornych na leczenie temozolomidem. W tej pracy wykazano, że jednoczesne podawanie THC i TMZ silnie nasilało autofagię w liniach komórkowych ludzkiego glejaka in vitro i w mysich ksenograftach nowotworowych in vivo.
Znaczący efekt przeciwnowotworowy zaobserwowano zarówno w podskórnych, jak i wewnątrzczaszkowych ksenograftach nowotworowych pochodzących z komórek glejaka. Autorzy twierdzą, że potencjalne wykorzystanie kannabinoidów jako środków przeciwnowotworowych zależy od tego, czy można osiągnąć ich skuteczne dawki u ludzi. Konwersja dawki szacuje, że podczas gdy dawki THC i CBD w zakresie od 5 do 10 mg/kg dziennie są odpowiednie do działania przeciwnowotworowego u myszy, u ludzi dawka ta będzie równoważna podawaniu od 25 do 50 mg THC i CBD dziennie.
Nanocząsteczki w leczeniu glekaja mózgu
Największy problem w opracowaniu leku na glejaka stanowi to, że ponad 98% leków drobnocząsteczkowych nie jest w stanie przekroczyć barier, aby dostać się do ośrodkowego układu nerwowego (OUN).
Nanocząsteczki (NPs) lub nanosystemy dostarczania leków są szeroko badane jako obiecująca strategia bezpośredniego dostarczania leków do OUN. Mogą potencjalnie utrzymywać terapeutyczny poziom leku, zwiększać jego stabilność i rozpuszczalność oraz skutecznie przekraczać barierę krew-mózg w leczeniu chorób mózgu. W warunkach przedklinicznych badacze ocenili różnorodne systemy NP do dostarczania leków do guza mózgu. Obejmują NP na bazie lipidów, polimerowe, dendrymery, micele i nieorganiczne, takie jak złoto, krzemionka i kropki kwantowe. Systemy te różnią się kluczowymi właściwościami fizykochemicznymi, takimi jak rozmiar, skład, kształt i atrybuty powierzchni. Te cechy dyktują ich zdolność do przechodzenia przez barierę krew-mózg, poruszania się po skomplikowanym mikrośrodowisku mózgu oraz specyficznego celowania i wchodzenia do chorych komórek. Doskonały przegląd badań przedklinicznych nanoterapeutyków dla GBM sugeruje obiecujące korzyści.
Właściwości fizyczne, chemiczne i biofarmaceutyczne CBD zostały zbadane w kilku badaniach. Właściwości fizykochemiczne kannabinoidów, które przyczyniają się do wyzwań związanych z dostarczaniem kannabinoidów, obejmują:
- niską rozpuszczalność w wodzie (2-10 μg / ml)
- podatność na autooksydację i degradację spowodowaną zmianami światła lub temperatury.
Agencja Żywności i Leków (FDA) zatwierdziła leki na bazie konopi indyjskich (np. Epidiolex, Syndros, Cesamet i Marinol). Zatwierdzone produkty mają postać doustną, co może ograniczać ich skuteczność terapeutyczną, dlatego nanotechnologia jest badana jako potencjalna metoda poprawy biodostępności i skuteczności terapeutycznej kannabinoidów.
„Technologia nanonośników została wykorzystana do zwiększenia skuteczności, stabilności, uwalniania i interakcji biofarmaceutycznych naturalnych i syntetycznych kannabinoidów oraz formulacji. Badania przedkliniczne i kliniczne zostały przeprowadzone z nanonośnikami koloidalnymi na bazie kannabinoidów w celu zbadania biokompatybilności, biodostępności i rozpuszczalności”. – informują naukowcy
Aktualne dane dotyczące stosowania medycznej marihuany w leczeniu glejaka
Pomimo stosowania obecnych terapii i ostatnich postępów w medycynie molekularnej, glejak pozostaje śmiertelną chorobą o bardzo złym rokowaniu. W związku z tym wymaga pilnej potrzeby ukierunkowania mechanizmów molekularnych odpowiedzialnych za jej progresję. Badania wskazują, że pacjenci przeżywają około 15 miesięcy po diagnozie, a kliniczne i biologiczne czynniki wpływające na przeżycie obejmują wyniki histologiczne, wiek w momencie rozpoznania, molekularne czynniki genetyczne, wielkość i lokalizację guza oraz zastosowane metody terapeutyczne. Glejak stanowi trudną do leczenia chorobę ze względu na swoją różnorodność, biologię komórkową i tkankową, genetykę, patofizjologię i reakcje terapeutyczne. Przyszłe leczenie musi koncentrować się na projektowaniu systemów dostarczania leków ukierunkowanych molekularnie. Odpowiednie leczenie musi nie tylko przezwyciężyć oporność na leki i promieniowanie, ale także mieć na celu uniknięcie skutków ubocznych i nawrotów.
„Kannabinoidy oferują bardziej skuteczną i tolerowaną opcję leczenia dla pacjentów z GBM. Kierując się tymi odkryciami, przewidujemy przyszłe badania zagłębiające się w precyzyjne szlaki sygnalizacyjne w układzie endokannabinoidowym, które pośredniczą w odpowiedzi glejaka na bodźce hormonalne, immunologiczne i mechaniczne. Ponadto, pilne jest zbadanie potencjału synergistycznych terapii skojarzonych, które integrują interwencje oparte na endokannabinoidach z istniejącymi metodami leczenia”. – podsumowują autorzy
Istnieją już pewne dowody sugerujące, że kannabinoidy mogą być skutecznymi substancjami uzupełniającymi obecne protokoły leczenia. Potrzebne są dalsze badania, aby ustalić je jako środki przeciwnowotworowe w leczeniu pacjentów z glejakiem. Tradycyjne metody leczenia to operacja, a następnie chemioterapia i radioterapia. Jednak te metody mogą być nieskuteczne z powodu chemiooporności, a także mogą mieć znaczące skutki uboczne. Kannabinoidy niszczą komórki nowotworowe, ale co ważne nie uszkadzają tych zdrowych. Nie możemy tego samego powiedzieć o chemioterapii, której następstwa mogą być drastyczne.
Jeżeli chcesz rozpocząć terapie medyczną marihuaną to sprawdź naszą zakładkę KLINIKI KONOPNE. Znajdziesz tam specjalistów z takich placówek jak KONOPNA KLINIKA, którzy umiejętnie poprowadzą twoją terapię.
Źródła:
- Dasram M.H., Naidoo P., Walker R.B., Khamanga S.M. (2024). International Journal of Molecular Sciences. Targeting the Endocannabinoid System Present in the Glioblastoma Tumour Microenvironment as a Potential Anti-Cancer Strategy
- Jot B. Marihuana leczy. (2014) Wydawnictwo MMJ.





















NAPISZ KOMENTARZ